Хирургическое лечение сердечной недостаточности
- Трансплантация сердца
- Реваскуляризация миокарда
- Коррекция недостаточности артриовентрикулярных клапанов
- Хирургическое ремоделирование левого желудочка
- Ресинхронизация сердца
- Вспомогательное кровообращение
- Реципиенты
Трансплантация сердца.
В РБ органная трансплантация осуществляется в соответствии с законом, в основе которого лежит "презумпция согласия": забор органа может быть осуществлен после констатации смерти мозга, если пожелания обратного не выражены пациентом до смерти.
Реципиент.
Основная цель подбора реципиентов состоит в том, чтобы идентифицировать больных с конечной стадией СН, невосприимчивых к медицикаментозному лечению, но обладающих потенциалом для возобновления нормальной активной жизни.
Показания к трансплантации сердца.
Реципиентами является больные с терминальной стадией СН, не подлежащие медикаментозной терапии или альтернативным хирургическим методам лечения сердечной недостаточности. Прогноз однолетней выживаемости без трансплантации < 50%. Объективными критериям такого прогноза являются: ФВ ЛЖ < 20%, Na сыворотки крови < 135 мэкв/л, давление заклинивания в легочной артерии > 25 мм рт.ст, уровень норадреналина в плазме > 600 пкг/мл, кардиоторакальный индекс > 0,6, снижение максимального VO2 < 10 мл/кг/мин. на фоне максимальной медикаментозной поддержки.
Первичное обследование реципиента включает тщательный анализ анамнеза и объективное исследование: рентгенографию грудной клетки, нагрузочный тест на максимальное потребление кислорода (VO2), рутинные гематологические и биохимические тесты, серологические исследование на наличие инфекционных заболеваний определение человеческого лимфоцитарного антигена (HLA). Проведение зондирование сердца с тонометрией правых отделов сердца с целью исключения необратимой легочной гипертензии перед постановкой пациентов в лист ожидания для трансплантации сердца - обязательно.
Фармакологический мост к трансплантации.
Больные с критической стадией терминальной недостаточности требуют лечения в отделении интенсивной терапии инфузионными инотропными средствами. У больных с недостаточным эффектом медикаментозного лечения используется интрааортальная баллонная контрпульсация.
Механический мост к трансплантации. У потенциальных реципиентов, которые остаются гемодинамически нестабильными в течение 24-48 часов при максимальной фармакологической поддержке применяются устройства моно-, бивентикулярного обхода желудочков или полное искусственное сердце.
Донор подвергается скринингу в три этапа. Первый этап заключается в сборе точной информации относительно возраста пациента, роста, веса, пола, группы крови и Rh-фактора, причины смерти, лабораторных данных, включая биохимические тесты, и серологические исследования на инфекционные заболевания (цитомегаловирус, гепатиты В и С). Второй этап скрининга включает дальнейшее исследование в поисках потенциальных противопоказаний: оценивается ЭКГ, грудная рентгенография, насыщение О2 артериальный крови и ЭхоКГ. Финальный этап скрининга донора происходит во время операции забора органа: оценивается функция желудочков, клапанная или коронарная патология.
Совместимость донора и реципиента.
Критерии совместимости базируются на соответствии группы крови по АВО и размере тела пациента. Вес донора должен быть в пределах 30% веса. Проводится скрининг реципиента на титр человеческого лимфоцитарного антигена (HLA). Положительная перекрестная реакция - абсолютное противопоказание к трансплантации. Увеличение количества реактивных антител (PRA) больше 10-15% указывает на повышенную чувствительность реципиента к аллоантигенам.
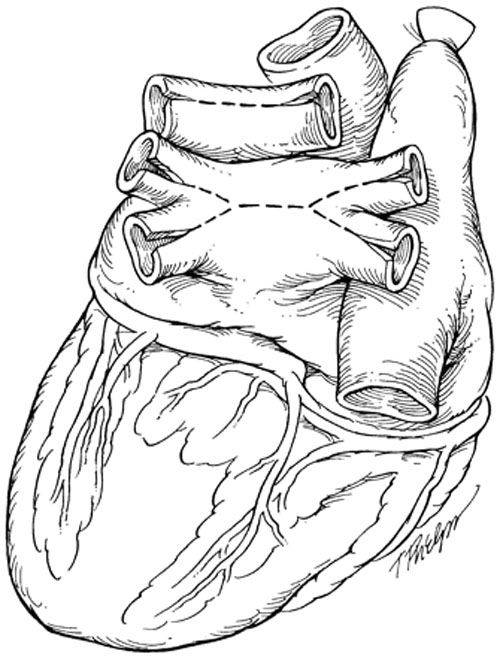
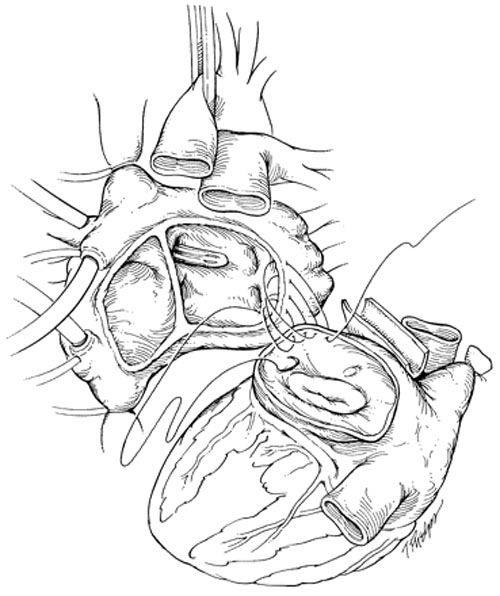
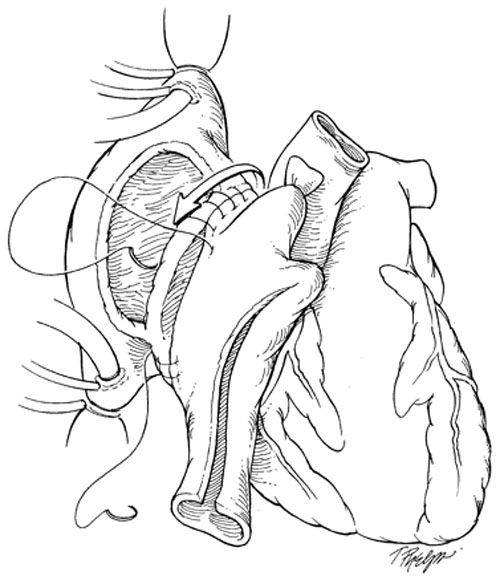
В РНПЦ для трансплантации сердца используется классическая методика N.Shumway.
 |
 |
 |
 |
Успешные и долгосрочные результаты ортотопической трансплантации сердца сделали ее методом выбора для пациентов с отсутствием эффекта от медикаментозного лечения. Однако, очевидные ограничения трансплантации, включающие потребность в иммунодепрессии и дефицит донорских органов не позволяют использовать этот метод лечения у всех пациентов. В РНПЦ для решения этой проблемы широко используются альтернативные хирургические методы лечения СН.
Реваскуляризация миокарда.
Успешная реваскуляризация миокарда у больных с ФВ < 30% может быть выполнена с невысокой госпитальной летальностью. Идеальными пациентами для выполнения реваскуляризации миокарда являются больные с хорошим дистальным коронарным руслом, наличием достаточно большого объема гибернирующего миокарда и отсутствием правожелудочковой недостаточности. Диагностика жизнеспособного миокарда с помощью сцинтиграфии, позволяющей отличить гибернирующий миокард от соединительнотканного рубца, также как и стрессЭхоКГ с добутамином является обязательными тестами для прогноза восстановления функции желудочков в послеоперационном периоде. Кроме того, с целью прогнозирования исхода операции проводится исследование уровня мозгового натрийуретического пептида (BNP). Уровень BNP < 400 пкг/мл является благоприятным прогностическим признаком исхода операции.
Коррекция недостаточности артриовентрикулярных клапанов.
Функциональная недостаточность атриовентрикулярных клапанов наблюдается почти у всех пациентов ишемической или дилатационной кардиомиопатией. Ишемия приводит к развитию прямой дисфункции или разрыву папиллярных мышц и формированию митральной недостаточности. Снижение контрактильности миокарда ЛЖ вызывает дилатацию его полости, дисторсию задней папиллярной мышцы и усиливает митральную регургитацию. Оратный сброс крови в левое предсердие увеличивает перегрузку объемом ЛЖ и еще больше усиливает ишемию миокарда. Возникает порочный круг, прервать который может только восстановление запирательной функции митрального клапана.
Для этого коррекции митральной недостаточности используются опорные кольца с измененной пространственной геометрией, которые позволяют снизить рецидив митральной недостаточности в отдаленном послеоперационном периоде.
 |
 |
Хирургическое ремоделирование левого желудочка.
Патологическое ремоделирование ЛЖ у больных с кардиомиопатией приводит к увеличению объема желудочка и напряжению его стенки. После того, как ЛЖ приобретает сферическую форму, меняется ориентация кардиомиоцитов. При одной и той же фракции укорочения фракция выброса в сферическом желудочке значительно уменьшается. При естественном течении заболевания 5-летняя выживаемость при КСИЛЖ < 100 мл/м2 составляет 85%, а при КСИЛЖ > 100 мл/м2 - 53%. Таким образом, любое вмешательство, направленное на оптимизацию этих отношений, оправдано, а благоприятный прогноз для пациента возможен при снижении КСИЛЖ < 90 мл/м2 .
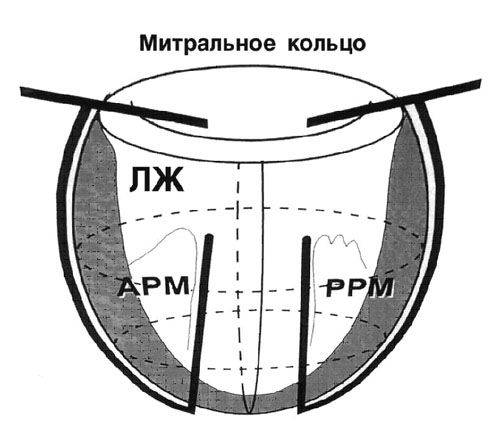
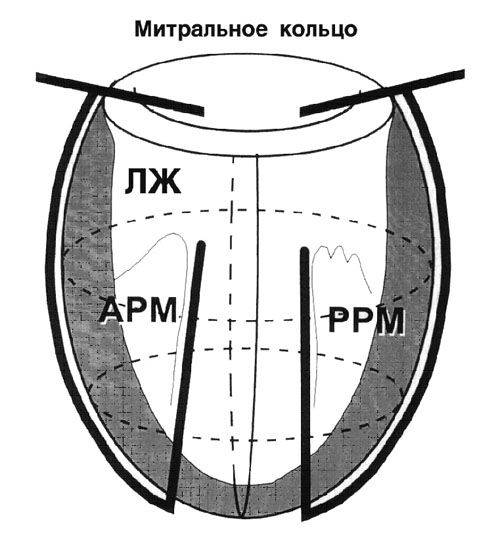
Способ циркулярной пластики.
Способ циркулярной пластики разработан с учетом восстановления геометрической формы и объема ЛЖ, близких к физиологической норме для данного пациента. Расчет нужного объема производится как функция нормального ударного индекса.
Оперативная техника.
Циркулярные швы, идущие в толще тканей на глубине не менее 5 миллиметров, накладывают со стороны эндокарда с шагом рассчитанным на основании эхокардиографических данных. Формируется конус ЛЖ с заранее рассчитанным конечнодиастолическим объемом.
 |
 |
После восстановления сердечной деятельности с помощью транспищеводной ЭхоКГ проводится оценка хирургического ремоделирования ЛЖ.
|
|
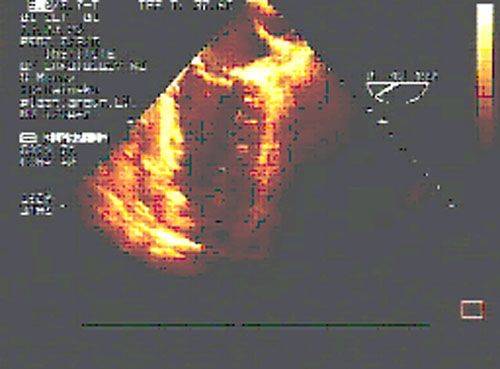 |
| до операции | после операции |
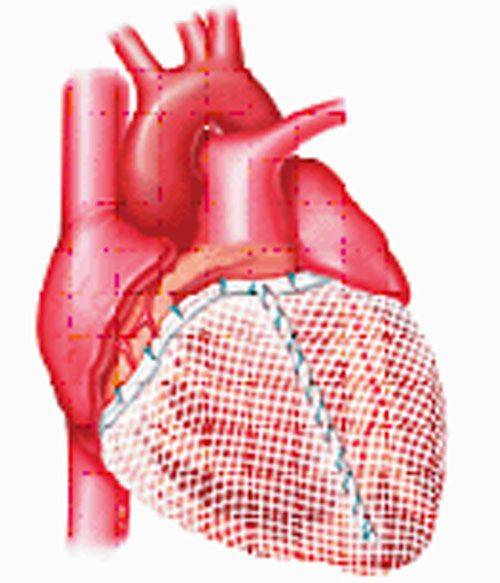
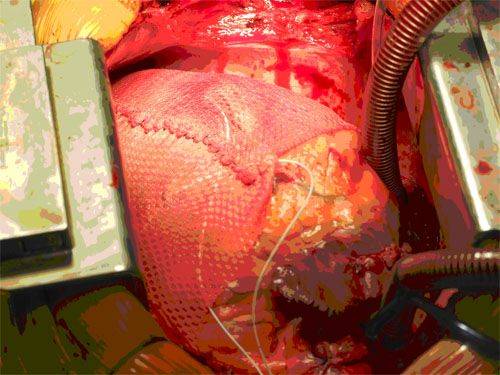
Поддерживающее устройство сердца.
Цель использования разработанного в РНПЦ устройства состоит в пассивной поддержке желудочков и предотвращении дальнейшей их дилатации. Экспериментальные исследования показали возможность уменьшения объема желудочков, снижение напряжение стенки, улучшение контрактильности миокарда и рост ФВ. Гистологические исследования животных также демонстрировали уменьшение гипертрофии миоцитов и интерстициального фиброза, а также снижение титра биохимических маркеров СН.
 |
 |
Ресинхронизация сердца.
Внутри- и межжелудочковая диссинхрония, связанная с задержкой внутри- и межжелудочкового проведения, является существенным компонентом патогенеза выраженной хронической сердечной недостаточности.
При СН изменяется внутри- и межкамерное взаимодействие. Нормальный физиологический асинхронизм между межжелудочковой перегородкой (МЖП) и задней стенкой ЛЖ (около 60 мсек.) нарастает и приводит к дисфункции ЛЖ.
Ресинхронизация сердца позволяет изменить степень электромеханической асинхронии предсердий и желудочков. Критерием прогнозирования успеха кардиосинхронизации является исходная пролонгация интервала QRS >130 мсек. Наиболее информативным критерием является оценка внутрижелудочковой механической задержки сокращения - увеличение исходного внутри- или межжелудочкового механического асинхронизма > 50 мсек.
Оперативная техника.
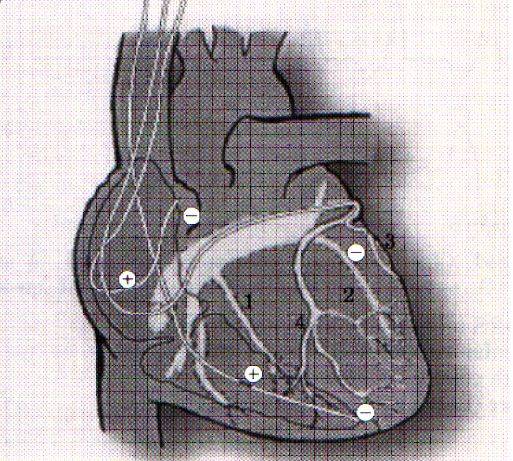
Коррекция указанных нарушений осуществляется путем имплантации многокамерного кардиостимулятора с раздельной стимуляцией правого предсердия и желудочков. Для этого три электрода проводятся через подключичную вену и фиксируются к стенке правого предсердия, в верхушке ПЖ и через коронарный синус в левой боковой вене ЛЖ у основания сердца.
 |
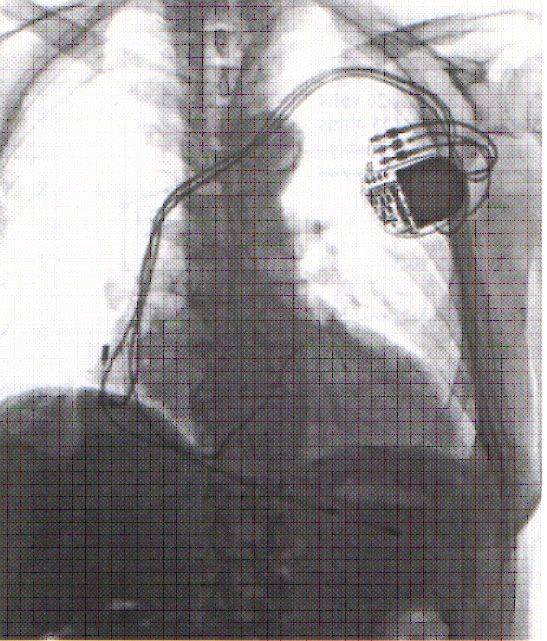 |
При открытых операциях реваскуляризации миокарда, ремоделирования ЛЖ или пластики митрального клапана электроды фиксируются эпикардиально - в правом предсердии и у основания сердца к обоим желудочкам.
Обязательным условием эффективности ресинхронизации является оптимизация работы кардиостимулятора.
Вспомогательное кровообращение.
Вследствие постоянного дефицита донорских органов большой группе пациентов целесообразно использовать длительную механическую поддержку кровообращения как основной терапии. Для этих целей могут быть использованы устройство Thoratec в виде моно или бивентрикулярногго обхода или аксиальный насос "HeartMate II".